Actividad antimicrobiana de diferentes extractos obtenidos a partir de la vieira patagónica (Zygochlamys patagonica)
DOI:
https://doi.org/10.47193/mafis.3322020301102Palabras clave:
Péptidos antimicrobianos, bivalvos, vieira patagónicaResumen
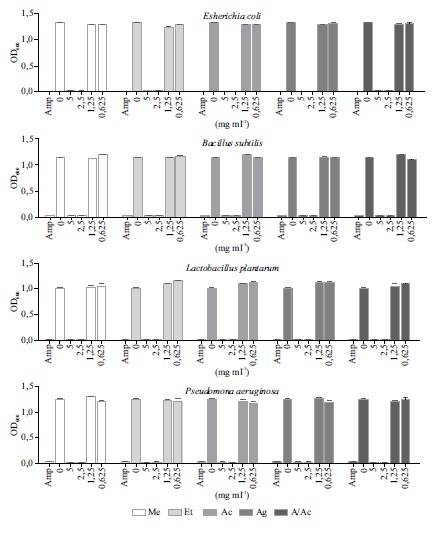
El uso excesivo de antibióticos en medicina, producción animal, agricultura y alimentos, ha contribuido a la aparición de patógenos resistentes a los antibióticos convencionales, haciendo necesaria la búsqueda de nuevos compuestos a partir de fuentes naturales y seguras. Ciertos péptidos de bajo peso molecular, con potencial actividad antimicrobiana, poseen alta especificidad para organismos procariotas y baja o nula toxicidad para los eucariotas. Los invertebrados marinos son una fuente posible para su obtención, ya que poseen un sistema inmune innato muy efectivo el cual es la primera línea de defensa frente a bacterias, hongos y virus. Una forma de obtenerlos es mediante la extracción con diferentes tipos de solventes que permiten mantener la función efectora de estas moléculas luego de su aislamiento. En este trabajo, a partir ejemplares de Zygochlamys patagonica se obtuvieron extractos con diferentes solventes y se compararon los rendimientos con el método control para la aislación de péptidos y proteínas. Se evaluó la concentración inhibitoria mínima (CIM) y la actividad antimicrobiana por medio de la determinación del porcentaje de inhibición del crecimiento de todos los extractos obtenidos sobre bacterias Gram positivas y Gram negativas, y se comparó su eficacia con un antibiótico comercial de amplio espectro. La CIM de los extractos provenientes de los tejidos de vieira (sin callos) fue de 2,5 mg ml-1, y la actividad antimicrobiana de los mismos fue comparable a la del antibiótico comercial de amplio espectro. De acuerdo con los resultados obtenidos, se recomienda utilizar etanol como método de extracción debido a su menor toxicidad y casi nula posibilidad de contaminación bacteriana durante el proceso. La identificación de estos péptidos podría contribuir a una futura aplicación biotecnológica.
Descargas
Métricas
Citas
Abouzeed YM, Zgheel F, Elfahem AA, Almarghe M, Dhawi A, Elbazl A, Hiblu MA, Kammon A, Ahmwd MO. 2018. Identification of phenolic compounds, antibacterial and antioxidant activities of raisin extracts. Open Vet J. 8 (4): 479-484.
Bahar AA, Ren D. 2013. Antimicrobial peptides. Pharm. 6: 1543-1575.
Boullet H, Bentot F, Hequet A, Ganem-Elbanz C, Bechara C, Pacreau E, Launay P, Sagan S, Jolivat C, Lacombe C, et al. 2019. Small antimicrobial peptide with in vivo activity against sepsis. Molecules. 24: 1702.
Campodónico S, Escolar M, García J, Aubone A. 2019. Síntesis histórica y estado actual de la pesquería de vieira patagónica Zygochlamys patagonica (King 1832) en la Argentina. Biología, evaluación de biomasa y manejo. Mar Fish Sci. 32 (2): 125-148.
[CLSI]. Clinical and Laboratory Standards Institute. 2012. Methods for dilution antimicrobial susceptibility tests for bacteria that grow aerobically; approved standard - Ninth Edition. CLSI document M07-A9.
Dunnett C. 1955. A Multiple Comparison Procedure for Comparing Several Treatments with a Control. J Am Stat Assoc. 50: 1096-1121.
Ennaas N, Hammami L, Beaulieu I, Fliss I. 2015. Purification and characterization of four antibacterial peptides from protames hydrolysate of Atlantic mackerel (Scomber scombrus) by-products. Biochem Biophys Res Commun. 462 (3): 195-200.
Geis J, Singh J, Teuber M. 1983. Potential of lactic streptococci to produce bacteriocin. Appl Environ Microbiol. 45 (1): 205-211.
Gutiérrez P, Orduz S. 2003. Péptidos antimicrobianos: estructura, función y aplicaciones. Actual Biol. 25 (78): 5-15.
Hancock Rew, Brown KL, Mookherjee N. 2006. Host defence peptides from invertebrates - emerging antimicrobial strategies. Immunobiology. 211: 315-322.
Hou Y, Wu X, Dai Z Wang G, Wu G. 2017. Protein hydrolysates in animal nutrition: Industrial production, bioactive peptides, and functional significance. J Anim Sci Biotechno. 8: 24.
Injal A, Kshirsagar S, Dev M, Parkar K, Kazi A, Chavan M, Kulkarni AS. 2016. Antimicrobial activity of extracts of hepatopancreas and mucus of bivalve, Meretrix meretrix. European J Biotechnol Biosci. 4: 36-38.
Kafle JK, Bhardwaj B, Kaur R, Kumar D, Banarjee D. 2018. A staining protocol of proteins on agarose gel with amido black. Acta Sci Med. Sciences. 7: 59-63.
Kim SK, Mendis E. 2006. Bioactive compounds from marine processing byproducts - A review. Food Res Int. 39: 383-393.
Kim R, Yokota H, Kim SH. 2000. Electrophoresis of proteins and protein/protein complexes in a native agarose gel. Anal Biochem. 282: 149-153.
Kiran N, Siddiqui G, Khan AN, Tushar P. 2014. Extraction and screening of bioactive compounds with antimicrobial properties from selected species of mollusk and crustacean. J Clin Cell Immunol. 5: 1.
Kuppusamy R, Willcox M, Black DS, Kumar N. 2019. Short cationic peptidomimetic antimicrobials. Antibiotics. 8: 44.
Lemus M, Salazar R, Lapo B, Chung K. 2016. Metalotineínas en bivalvos marinos. Lat Am J Aquat Res. 44: 202-215.
Lonza Research. 2019. Section XIII: Protein Separation in Agarose Gels. https://www.lonza.com/research.
Lordan S, Paul Ross R, Stanton C. 2011. Marine bioactives as functional food ingredients: potential to reduce the incidence of chronic diseases. Mar Drugs. 9: 1056-1100.
Najafian RL, Babji AS. 2012. A review of fish-derived antioxidant and antimicrobial peptides: Their production, assessment, and applications. Peptides. 33: 178-185.
Niu L, Zhang H, Wu Z, Wang Y, Liu H, Wu X, Wang, W. 2019. Modified TCA/acetone precipitation of plant proteins for proteomic analysis. PLoS One. 14(1):e0211612. DOI: https://doi.org/10.1371/journal.pone.0211612
Pachaiyappan A, Sadhasivam G, Kumar M, Muthuvel A. 2014. Antibacterial activity of different solvent extracts of marine bivalve, Meretrix casta. Curr Biotica. 8: 270-277.
Ryan JT, Paul Ross R, Bolton D, Fitzgeral GF, Stanton C. 2011. Bioactive peptides from muscle sources: meat and fish. Nutrients. 3: 765-791.
Salomone AL, Massa AE. 2018. Evaluación de la capacidad antimicrobiana de hidrolizados enzimáticos obtenidos a partir de subproductos de merluza. Inf. Invest INIDEP N° 10/2018. 11 p.
Schwartz M, Campodónico MS. 2017. Primera descripción del desarrollo embrionario y larval temprano de la vieira patagónica (Zygochlamys patagonica). Inf Invest INIDEP Nº 105/2017. 10 p.
Shahidi F, Zhong Y. 2008. Bioactive peptides. J AOAC Int. 9: 914-31.
Sharma S, Chatterji A, Das P. 2009. Effect of different extraction procedures on antimicrobial activity of marine bivalves: a comparison. Pertanika J Trop Agric Sci. 32: 77-83.
Sugesh S, Mayavu P. 2013. Antimicrobial activities of two edible bivalves M. meretrix and M. casta. Pak J Biol Sci. 16: 38-43.
Tan SC, Yiap BC. 2009. DNA, RNA, and protein extraction: the past and the present. J Biomed Biotechnol. DOI: https://doi.org/10.1155/2009/574398
Thermo Fisher Scientific Inc. 2009. Acetone precipitation of proteins. TR0049.1. https://www.thermo.com/pierce.
Tincu JA, Taylor SW. 2004. Antimicrobial peptides from marine invertebrates. Antimicrob. Agents Chemother. 48: 3645-3654.
Wang X, Yu H, Xing R, Li P. 2017. Characterization, preparation, and purification of marine bioactive peptides. Hindawi BioMed Res Int. Article ID 9746720.
Wu M, Kusukawa N. 1998. SDS Agarose Gels for Analysis of Proteins. BioTechniques. 24: 676-678.
Publicado
Cómo citar
Número
Sección
Licencia
Derechos de autor 2020 Andrea Salomone

Esta obra está bajo una licencia internacional Creative Commons Atribución-NoComercial-CompartirIgual 4.0.
Los autores de los artículos publicados en Marine and Fishery Sciences conservan los derechos de autor de sus artículos, a excepción de las imágenes de terceros y otros materiales añadidos por Marine and Fishery Sciences, que están sujetos a los derechos de autor de sus respectivos propietarios. Por lo tanto, los autores son libres de difundir y volver a publicar sus artículos, sujeto a los requisitos de los propietarios de derechos de autor de terceros y sujeto a que la publicación original sea completamente citada. Los visitantes también pueden descargar y reenviar artículos sujetos a los requisitos de citas. La capacidad de copiar, descargar, reenviar o distribuir cualquier material siempre está sujeta a los avisos de derechos de autor que se muestran. Los avisos de copyright deben mostrarse de manera prominente y no pueden borrarse, eliminarse u ocultarse, total o parcialmente. El autoalmacenamiento en servidores y repositorios de preimpresión está permitido para todas las versiones.
Esta revista ofrece a los autores una política de acceso abierto. Los usuarios pueden leer, descargar, copiar, distribuir, imprimir, buscar o vincular los textos completos de los artículos, o usarlos para cualquier otro propósito legal dentro de la licencia Creative Commons 4.0 (BY-NC-SA), sin solicitar permiso previo del editor o del autor. Esto está de acuerdo con la definición BOAI de acceso abierto.



























